Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
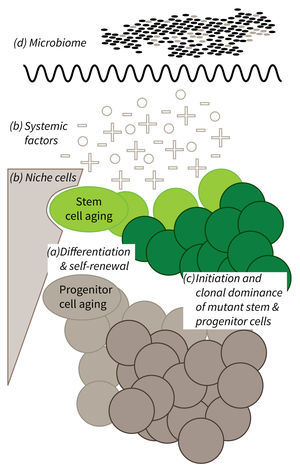
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2016
- Neuron-Specific Deletion of the Nf2 Tumor Suppressor Impairs Functional Nerve Regeneration.
Schulz A, Büttner R, Toledo A, Baader SL, von Maltzahn J, Irintchev A, Bauer R, Morrison H
PLoS One 2016, 11(7), e0159718 - Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals.
Schwörer S, Becker F, Feller C, Baig AH, Köber U, Henze H, Kraus JM, Xin B, Lechel A, Lipka DB, Varghese CS, Schmidt M, Rohs R, Aebersold R, Medina KL, Kestler HA, Neri F, von Maltzahn** J, Tümpel** S, Rudolph** KL
Nature 2016, 540(7633), 428-32 ** co-corresponding authors - Dietary restriction improves repopulation but impairs lymphoid differentiation capacity of hematopoietic stem cells in early aging.
Tang D, Tao S, Chen Z, Koliesnik IO, Calmes PG, Hoerr V, Han B, Gebert N, Zörnig M, Löffler B, Morita** Y, Rudolph** KL
J Exp Med 2016, 213(4), 535-53 ** co-corresponding authors - Characterization of SKAP/Kinastrin isoforms - The N-terminus defines tissue specificity and Pontin binding.
Vranesic AC, Reiche J, Hoischen C, Wohlmann A, Bratsch J, Friedrich K, Günes B, Cappallo-Obermann H, Kirchhoff C, Diekmann S, Günes C, Huber O
Hum Mol Genet 2016, 25(13), 2838-52 - SIRT6 Controls Hematopoietic Stem Cell Homeostasis through Epigenetic Regulation of Wnt Signaling.
Wang H, Diao D, Shi Z, Zhu X, Gao Y, Gao S, Liu X, Wu Y, Rudolph KL, Liu G, Li T, Ju Z
Cell Stem Cell 2016, 18(4), 495-507 - Per2 induction limits lymphoid-biased haematopoietic stem cells and lymphopoiesis in the context of DNA damage and ageing.
Wang J, Morita Y, Han B, Niemann S, Löffler B, Rudolph KL
Nat Cell Biol 2016, 18(5), 480-90 recommended by "Faculty of 1000" - Prime - Classical and alternative NF-κB signaling cooperate in regulating adipocyte differentiation and function.
Weidemann A, Lovas A, Rauch A, Andreas N, von Maltzahn J, Riemann M, Weih F
Int J Obes Relat Metab Disord 2016, 40(3), 452-9