Ehemalige Fellow-Gruppe Cirstea (bis 2017)
Dr. Ion Cirstea (ehemalige Fellow-Gruppe) ist ans der Universität Ulm gewechselt, wo er seine Arbeiten zu alterns- und hormonbedingten Veränderungen der Expression und Aktivierung von RAS GTPasen und nachgelagerter Signalwege fortsetzt.
Zelluläre Signalwege:
Kleine molekulare Schalter
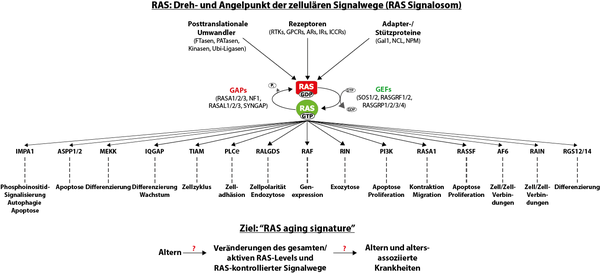
Die kleinen GTPasen der RAS Proteinfamilie fungieren als molekulare Schalter in einer Vielzahl zellulärer Signalwege, indem sie zwischen einer aktiven, GTP-gebundenen, und einer inaktiven, GDP-gebundenen Form hin und her schalten. In der aktiven, GTP-gebundenen Form interagiert RAS mit einem breiten Spektrum funktionell unterschiedlicher Effektoren, reguliert ihre Funktion und kontrolliert dadurch viele biologische Prozesse, z.B. Proliferation, Differenzierung, Apoptose und Migration.
Somatische Mutationen des HRAS Gens (Codons 12, 13 und 61) führen zu Krebs, wogegen Keimbahnmutationen (Codon 12 ist am häufigsten betroffen) zu einer seltenen Erkrankung führen, die Costello Syndrom genannt wird. RAS Mutationen am Codon 12 erzeugen ein konstitutiv aktives RAS Protein, was zur Hyperaktivierung der nachgeschalteten Signalwege führt. CS Patienten erreichen das Erwachsenenalter und weisen Papillome, Verlust des Kopfhaares, hypertrophe Kardiomyopathie, reduzierten Muskeltonus, Osteoporose, Haltungsschäden und ein auffälliges, frühzeitig gealtertes Erscheinungsbild auf. Obwohl die Mutationen die gleichen Aminosäurereste betreffen wie die onkogenen RAS Mutationen, entwickeln CS Patienten nur selten Krebs, der nur in jüngeren Jahren häufiger als in der durchschnittlichen Bevölkerung auftritt.
Zusammengenommen führen diese Beobachtungen uns zu der Hypothese, dass die Hyperaktivierung von HRAS im Costello Syndrom durch bisher unbekannte Mechanismen zu frühzeitigem Altern sowie zu einer gewissen Resistenz gegen onkogene Transformation führt.
Mit Methoden aus der Proteinbiochemie und der Zellbiologie sowie mit Hilfe von Mausmodellen untersuchen wir den mechanistischen Zusammenhang zwischen Altern und Krebs. Des Weiteren versuchen wir das Expressionsmuster von RAS sowie dessen Aktivierung zu verstehen und von RAS regulierte Signalwege zu erforschen, die im Alterungsprozess induziert werden („RAS aging signature“). Letzten Endes wollen wir inhibitorische Moleküle identifizieren, um neue Therapien zu entwickeln, die die Behandlung erblich bedingter Erkrankungen bereits vor der Geburt ermöglichen sowie die Lebensqualität im Alter steigern.