Ehemalige Forschungsgruppe Than (bis 2015)
Projekte
Die Forschungsgruppe um Manuel Than beschäftigte sich am FLI mit der Alzheimer-Krankheit und dem β-Amyloid-Vorläufer-Proteins (APP). Außerdem lag ein Forschungsschwerpunkt auf PC-Inhibitoren und der Neu- und Weiterentwicklung proteinkristallographischer Methoden.
Bei dieser weltweit häufigsten Form der Demenz lagern sich sogenannte „senile Plaques“ im Gehirn ab. Sie bestehen vorwiegend aus amyloiden β-Peptiden (Aβ) und entstehen aus der enzymatischen Spaltung des β-Amyloid-Vorläufer-Proteins (APP). In den letzten Jahren sind die krankmachenden Schritte, die Aβ entstehen lassen, zunehmend besser verstanden worden. Bis heute ist jedoch nur wenig über die atomaren Strukturen der beteiligten Moleküle bekannt, über ihre Wechselwirkungen und ihre physiologische Funktion. Dies zu untersuchen, war der Ausgangspunkt vieler unserer Forschungsprojekte.
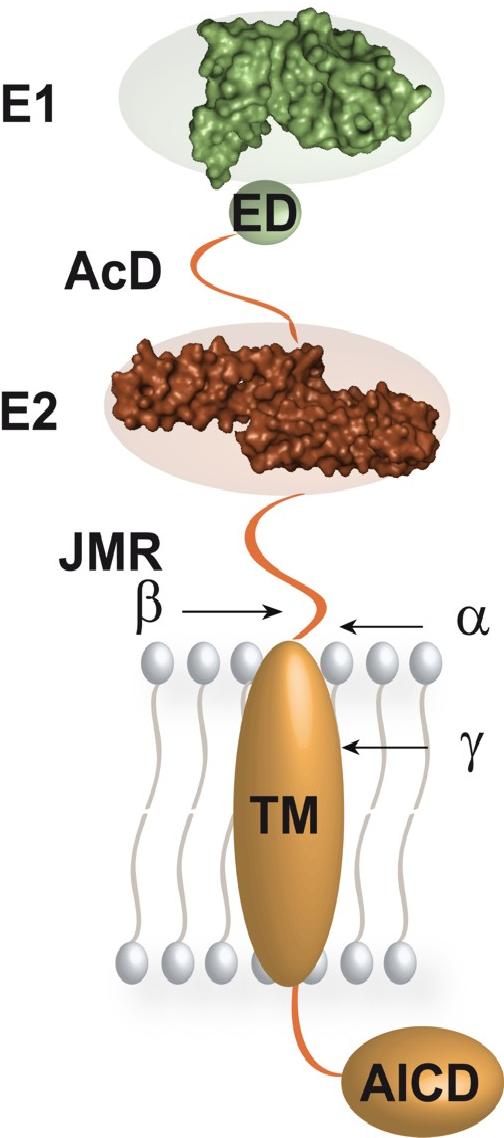
Die Ektodomäne des Typ-1 Transmembranproteins APP besteht, wie für ein typisches Multidomänenprotein zu erwarten ist, aus gefalteten und flexiblen Bereichen. Unsere biochemischen und biophysikalischen Analysen seiner genauen Architektur zeigten die Existenz und die genauen Grenzen der zwei Domänen E1 und E2, die jeweils eine definierte Sekundärstruktur aufweisen. Sie sind untereinander und mit der Transmebranhelix des APP durch flexible Bereiche verknüpft. E1 und E2 verbindet ein Sequenzbereich, der vorwiegend sauer geladene Aminosären aufweist und entsprechend Acide Domäne (AcD) genannt wird. Zwischen der AcD und E1 liegt im Wirbeltier-APP eine zusätzliche konservierte Domäne von teilweiser Flexibilität, die "extension domain" (ED).
Die flexible "juxtamembrane region" (JMR) verbindet E2 mit der Tranmembranhelix des APP und enthält die Schnittstellen der α- und β-Sekretasen. Die γ-Sekretase schneidet innerhalb der Transmembranhelix. APP bildet ein gestrecktes Molekül, welches flexibel mit der Membran verbunden ist und keine ausgeprägte Wechselwirkung seiner konstituierenden Domänen und Segmente aufweist. Im nächsthöheren Organisationslevel ist APP wahrscheinlich in verschiedene Oligomerisierungskontakte und weitere Protein-Protein-Wechselwirkungen involviert, welche auf der hier gezeigten dreidimensionalen Struktur des isolierten, monomeren APP aufbauen.
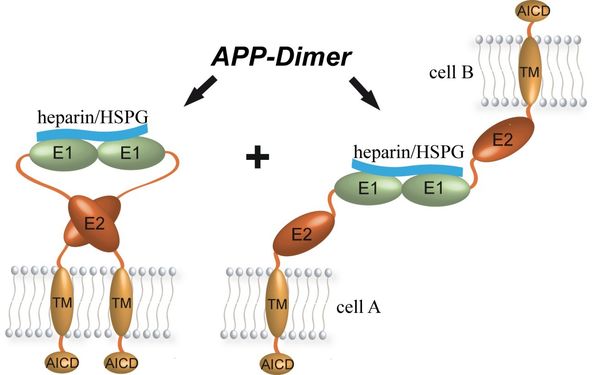
Es wird weithin davon ausgegangen, dass die Dimerisierung von APP für dessen physiologische Funktion und Prozessierung in der AD von zentraler Bedeutung ist. So beeinflusst sie z. B. die Bildung von Aβ, die Wechselwirkung zwischen APP und der ECM sowie die APP-abhängige Zell-Zell-Interaktion und wird generell auch bei Rezeptoraktivitäten beobachtet. Unter Verwendung biochemischer und biophysikalischer Methoden haben wir untersucht, welche Bereiche des APP mit hoher Affinität (entsprechend einem niedrigen KD) auch bei geringer Proteinkonzentration miteinander wechselwirken und welche Kontakte mit nur geringer Affinität gebildet werden und daher das sekundäre Ergebnis anderer Interaktionen darstellen, welche energetisch zuerst ausgebildet werden müssen.
Sowohl E1 als auch E2 können schwache Dimerkontakte ausbilden, jedoch interagiert nur E1 mit kurzen Heparinketten in einer Art und Weise, welche existierende Protein-Protein-Kontakte stabilisieren kann. Entsprechend wird die Dimerisierung von APP energetisch durch eine Heparin-abhängige Dimerisierung seiner E1-Domäne induziert, welche in der Dimerisierung von E2 und wahrscheinlich auch des Transmembranbereiches des APP (TM) resultiert und von der zellulären Lage des APP abhängig ist. Entsprechend kann APP sowohl cis- als auch trans-Dimere ausbilden. Im ersten Fall gehen beide APP-Moleküle von der gleichen Membran aus. Trans-Dimere entstehen aufgrund einer Heparin-abhängigen Dimerisierung von zwei E1-Domänen, die von APP-Molekülen gegenüberliegender Membranen ausgehen.
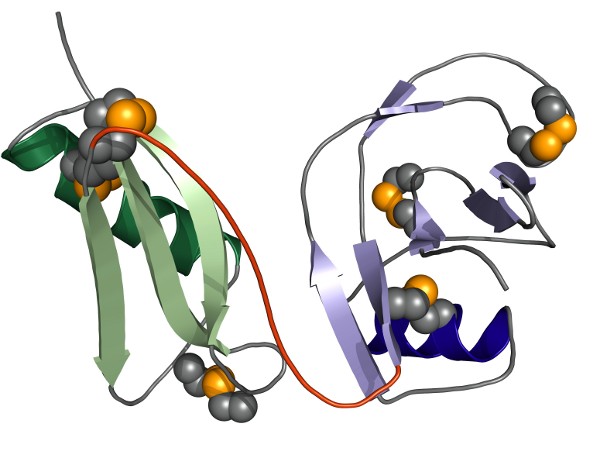
Unsere Kristallstruktur der gesamten E1-Domäne des APP zeigt, daß die beiden sie bildenden Untereinheiten, die sogenannte "growth factor like domain" (GFLD) und die "copper binding domain" (CuBD), eine strukturelle und somit funktionelle Einheit bilden. Bei leicht saurem (vesikulärem) pH bilden die beiden Untereinheiten eine fest verbundene Einheit. Interessanterweise zeigt diese Wechselwirkung bei neutralem bis leicht basischem (extrazellulärem) pH eine gewisse Plastizität, was eine Abhängigkeit dieser Wechselwirkung von der zellulären Lokalisation des APP nahelegt. Wir sehen sowohl in biochemischen Studien als auch im Kristall, daß zwei E1-Einheiten ein Dimer ausbilden.
Diese E1-basierte Dimerisierung des APP wird durch Heparin induziert und stabilisiert, welches wahrscheinlich die physiologisch weiter verbreiteten Heparansulfat-Proteoglycane (HSPGs) nachbildet. Die pH-Abhängigkeit der Wechselwirkung zwischen GFLD und CuBD wurde vor Kurzem durch uns näher charakterisiert. Unsere Daten zeigen, dass spezifische Wasserstoffbrückenbindungen zwischen Asp177 und Glu87 sowie zwischen Asn89 und His147 für diesen pH-getriebenen Konformationsschalter in APP-E1 hauptverantwortlich sind.
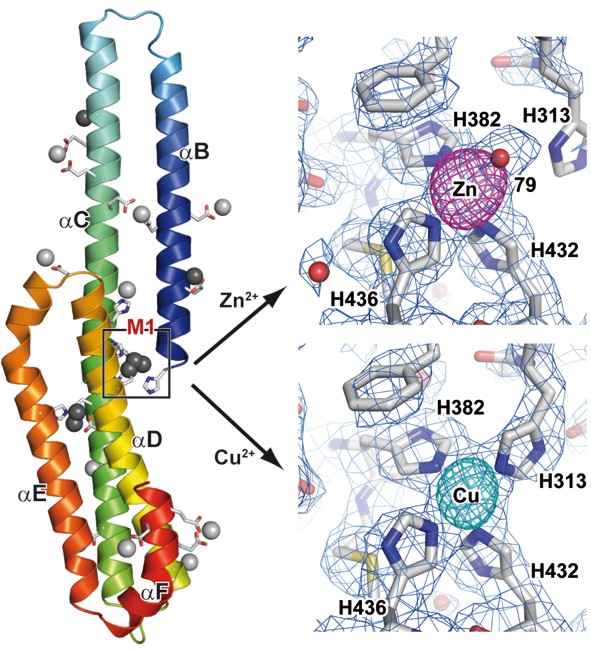
Unsere biochemische und röntgenkristallographische Analyse der E2-Domäne des APP identifizierte einen metall-abhängigen "molekularen Schalter" in diesem Teil des APP. Vier evolutionär hochkonservierte Histidinreste binden spezifisch und mit hoher Affinität unter physiologischen Konzentrationen an Kupfer und Zink. Metall-spezifische Koordinationssphären induzieren große konformationelle Änderungen. Sie führen zu unterschiedlichen strukturellen Zuständen, welche wahrscheinlich sowohl die physiologische Funktion des APP als auch dessen proteolytische Spaltung bei der Entstehung von AD beeinflussen. In darauf folgenden und von dieser strukturellen Analyse ausgehenden Mutationsexperimenten konnten wir zeigen, dass His313 verzichtbar für die Bindung von Zn2+ ist, während His382 als Ligand für beide Ionen fungiert.
Entsprechend beeinflusst die Mutation von His313 zu Alanin ausschließlich die Bindung von Cu2+ an M1, während eine Mutation von His382 zu Alanin jeglichen Effekt der Metallbindung an M1 auf E2 verhindert. Der entsprechende Effekt auf die Interaktion von APP wird nur für extrazelluläre jedoch nicht für intrazelluläre Bindepartner beobachtet, konsistent mit einer Regulation dieser Wechselwirkungen durch die extrazelluläre Konzentration an Metallionen, welche an M1 binden.
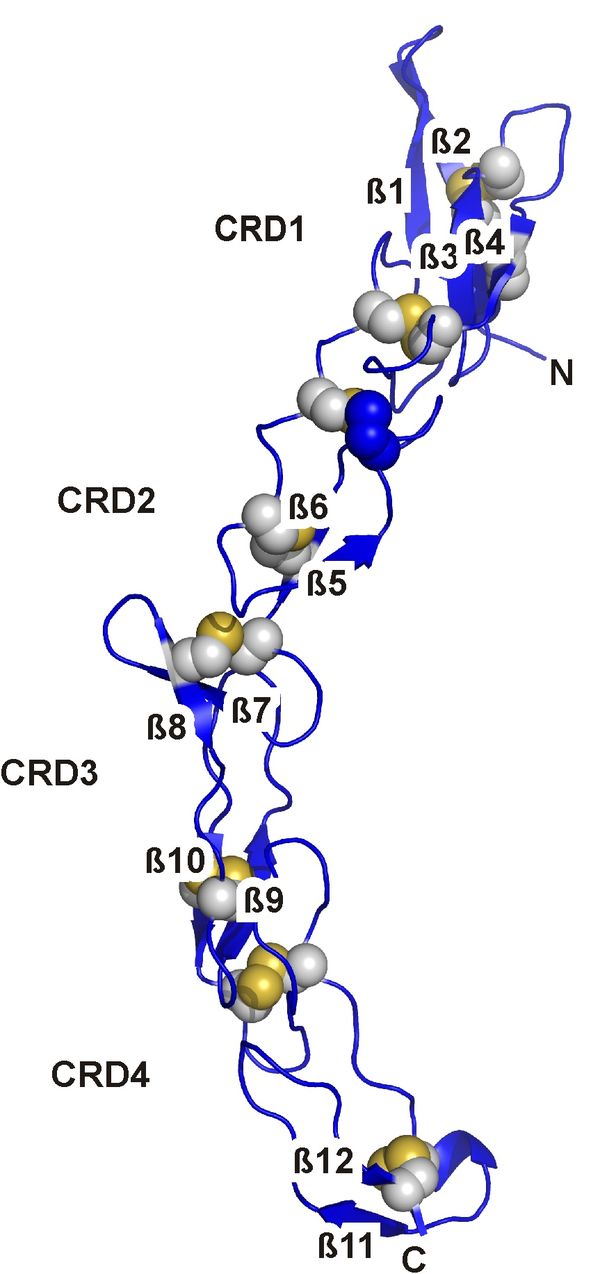
Vor kurzem konnten wir die Kristallstruktur der extrazellulären Domäne des "death receptor six" (DR6) aufklären. Diese Arbeit ist Teil unserer Untersuchungen von Interaktionspartnern des APP und deren Einfluß auf die Entstehung von AD. DR6 gehört zur Superfamilie der Tumornekrosefaktor-Rezeptoren (TNFR), deren Familienmitglieder von zentraler Bedeutung für die Signaltransduktionsprozesse bei der Apoptose, der zellulären Stressantwort sowie dem Überleben von Zellen sind. Es wurde gezeigt, daß DR6 als Rezeptor für lösliche N-terminale APP-Spezies dient und dabei zur Rückbildung von Axonen sowie zum Absterben von Neuronen führen kann. Die Cystein-reiche Domäne des DR6, der Ligandenbindungsbereich der TNFR-Familienmitglider, zeigt eine typische Faltung dieser Domäne und bildet eine DR6-spezifische Oberfläche aus, welche die selektive Erkennung von Liganden ermöglicht. Der Vergleich des APP zu bekannten, typischen Liganden der TNFR-Familie zeigt jedoch eine atypische Symmetrie und Struktur für dieses Molekül und legt die Vermutung nahe, daß APP anders mit DR6 wechselwirkt als typische TNFR-Liganden.
Viele Proteine und Peptide müssen in Eukaryoten während der Sekretion erst durch eine spezielle Klasse von Serinproteasen, die Proprotein/Prohormon Convertasen (PCs), proteolytisch gespalten werden, um aktiv zu werden. Zu diesen PC-Substraten zählen Peptid-Hormone (z. B. Insulin), extrazelluläre Proteasen, Wachstums- und Differenzierungsfaktoren (vielen wird eine zentrale Rolle bei neurodegenerativen Krankheiten, der Entstehung von Krebs sowie bei der Metastase zugewiesen), aber auch bakterielle Toxine und virale Hüllproteine. Entsprechend stellen die PCs ein hochinteressantes pharmakologisches Zielmolekül dar. Aufgrund unserer dreidimensionalen Struktur des Furins komplementiert durch weitere Studien anderer Arbeitsgruppen haben wir begonnen zu verstehen, wie insbesondere Furin, aber auch generell diese Klasse von hochspezifischen Endoproteasen ihre Substrate erkennen und spalten.
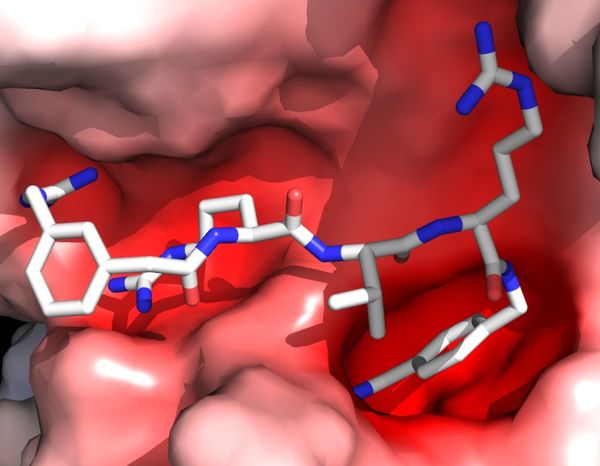
Vor kurzem konnten wir ein neuartiges Expressions- und Kristallisationssystem entwickeln, welches es uns erlaubte, die Wechselwirkung zwischen humanem Furin und pharmazeutisch wichtigen Inhibitoren effizient zu untersuchen. Dies ermöglichte eine molekulare Untersuchung ihrer Wechselwirkungen sowie ihre rationelle struktur-basierte Entwicklung. Die spezifischen Kontakte sind
- auf eine Komplementarität der Ladung der negativ geladenen Substratbindefurche von Furin und der positiv geladenen Seitenketten des Inhibitors sowie
- auf eine Reihe von hoch-spezifischen Wasserstoff-Brückenbindungen und weitere Kontakte
zurückzuführen, welche sich sowohl auf die P1 als auch auf die atypisch wechselwirkenden P4 und P5 Seitenketten konzentrieren. Entwickelte Inhibitoren zeigen eine geringe Nebenreaktion und große schützende Effekte in verschiedenen Modellen der viralen Infektion.
In zukünftigen Projekten möchten wir unser strukturelles Verständnis, die rationale, Struktur-basierte Entwicklung von Inhibitoren und deren pharmazeutische Anwendung sowohl auf weitere PC-Familienmitglieder aber auch auf weitere Krankheitsbilder ausdehnen.
Bei der primär auf das Strukturverständnis unserer Zielproteine ausgerichteten proteinkristallographischen Arbeit stoßen wir immer wieder auf die Notwendigkeit, neue Methoden zu etablieren, zu adaptieren oder komplett neu zu entwickeln. Hierzu zählte in den letzten Jahren die Verwendung einer speziellen element-spezifischen Elektronendichtekarte, berechnet unter Zuhilfenahme der Anomalen Differenzen aus Diffraktionsmessungen an der K-Absorptionskante von Calcium, die uns eindeutig die Anzahl sowie die räumliche Lage der im Furin gebundenen Ca2+-Ionen zeigte. Kürzlich konnten wir diese Methode erfolgreich zur Untersuchung spezifischer Metallbindestellen am APP einsetzen. Im Rahmen der Strukturbestimmung des DR6 entwickelten wir einen neuartigen Ansatz zur experimentellen Phasenbestimmung in der Proteinkristallographie unter Verwendung von Schweratom-Clusterverbindungen und Molekularem Ersatz sowie von isomorphen oder anomalen Differenzen. Des Weiteren ist die Transformation von Proteinkristallen durch gezielte Feuchteänderungen oft von großer Hilfe, um die innere Ordnung von Kristallen zu erhöhen und somit die Strukturlösung zu ermöglichen.