Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
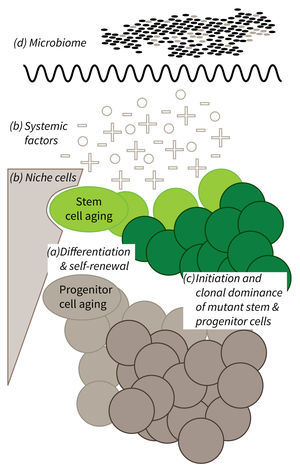
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2019
- Sirt1 deletion improves intestinal atrophy in telomere dysfunctional mice by impairing induction of DNA damage responses
Kim I
Dissertation 2019, Jena, Germany - The WT1-like transcription factor Klumpfuss maintains lineage commitment of enterocyte progenitors in the Drosophila intestine.
Korzelius** J, Azami S, Ronnen-Oron T, Koch P, Baldauf M, Meier E, Rodriguez-Fernandez IA, Groth M, Sousa-Victor P, Jasper** H
Nat Commun 2019, 10(1), 4123 ** co-corresponding authors - The peripheral differentiation of human natural killer T cells.
Liu J, Hill BJ, Darko S, Song K, Quigley MF, Asher TE, Morita Y, Greenaway HY, Venturi V, Douek DC, Davenport MP, Price DA, Roederer M
Immunol Cell Biol 2019, 97(6), 586-96 - Memantine potentiates cytarabine-induced cell death of acute leukemia correlating with inhibition of Kv 1.3 potassium channels, AKT and ERK1/2 signaling.
Lowinus T, Heidel FH, Bose T, Nimmagadda SC, Schnöder T, Cammann C, Schmitz I, Seifert U, Fischer T, Schraven B, Bommhardt U
Cell Commun Signal 2019, 17(1), 5 - Prospective isolation of non-hematopoietic cells of the niche and their differential molecular interactions with HSCs.
Mende* N, Jolly* A, Percin* GI, Günther M, Rostovskaya M, Krishnan SM, Oostendorp RAJ, Dahl A, Anastassiadis K, Höfer** T, Waskow** C
Blood 2019, 134(15), 1214-26 * equal contribution, ** co-senior authors - Differences in expression rather than methylation at placenta-specific imprinted loci is associated with intrauterine growth restriction.
Monteagudo-Sánchez A, Sánchez-Delgado M, Mora JRH, Santamaría NT, Gratacós E, Esteller M, de Heredia ML, Nunes V, Choux C, Fauque P, de Nanclares GP, Anton L, Elovitz MA, Iglesias-Platas I, Monk D
Clin Epigenetics 2019, 11(1), 35 - ORP3 is a tumor suppressor protein in the B-cell lineage of aging mice
Njeru SN
Dissertation 2019, Jena, Germany - Plasma VCAM1 levels correlate with disease severity in Parkinson's disease.
Perner C, Perner F, Gaur N, Zimmermann S, Witte OW, Heidel FH, Grosskreutz J, Prell T
J Neuroinflammation 2019, 16(1), 94 - Roles of JAK2 in Aging, Inflammation, Hematopoiesis and Malignant Transformation.
Perner F, Perner C, Ernst T, Heidel FH
Cells 2019, 8(8) - Loss of a proteostatic checkpoint in intestinal stem cells contributes to age-related epithelial dysfunction.
Rodriguez-Fernandez IA, Qi Y, Jasper H
Nat Commun 2019, 10(1), 1050