Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
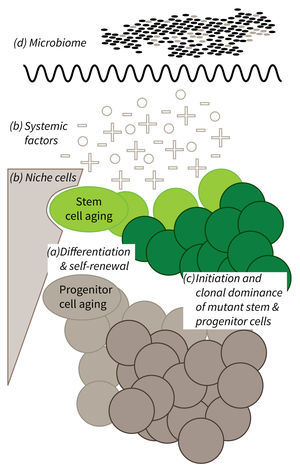
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2020
- High Canonical Wnt/β-Catenin Activity Sensitizes Murine Hematopoietic Stem and Progenitor Cells to DNA Damage.
Wang Y, Cui H, Tao S, Zeng T, Wu J, Tao Z, Zhang L, Zou B, Chen Z, Garside GB, Tang D
Stem Cell Rev Rep 2020, 16(1), 212-21 - S1P lyase inhibition protects against sepsis by promoting disease tolerance via the S1P/S1PR3 axis.
Weigel C, Hüttner SS, Ludwig K, Krieg N, Hofmann S, Schröder NH, Robbe L, Kluge S, Nierhaus A, Winkler MS, Rubio I, von Maltzahn J, Spiegel S, Gräler MH
EBioMedicine 2020, 58, 102898 - Ontogeny of arterial macrophages defines their functions in homeostasis and inflammation.
Weinberger T, Esfandyari D, Messerer D, Percin G, Schleifer C, Thaler R, Liu L, Stremmel C, Schneider V, Vagnozzi RJ, Schwanenkamp J, Fischer M, Busch K, Klapproth K, Ishikawa-Ankerhold H, Klösges L, Titova A, Molkentin JD, Kobayashi Y, Engelhardt S, Massberg S, Waskow C, Perdiguero EG, Schulz C
Nat Commun 2020, 11(1), 4549
2019
- Analyzing Satellite Cell Function During Skeletal Muscle Regeneration by Cardiotoxin Injury and Injection of Self-delivering siRNA In Vivo.
Ahrens* HE, Henze* H, Schüler SC, Schmidt M, Hüttner SS, von Maltzahn J
J Vis Exp 2019, e60194 * equal contribution - Adaptive immunodeficiency accelerates the development of intestinal atrophy in telomere dysfunctional mice during ageing
Bajwa S
Dissertation 2019, Jena, Germany - Igfbp7 knock-down perturbs hemotopoiesis and causes an MPN-like phenotype in aging mice
Calmes PG
Dissertation 2019, Jena, Germany - Cohesin-mediated NF-κB signaling limits hematopoietic stem cell self-renewal in aging and inflammation.
Chen Z, Amro EM, Becker F, Hölzer M, Rasa SMM, Njeru SN, Han B, Di Sanzo S, Chen Y, Tang D, Tao S, Haenold R, Groth M, Romanov VS, Kirkpatrick JM, Kraus JM, Kestler HA, Marz M, Ori A, Neri F, Morita** Y, Rudolph** KL
J Exp Med 2019, 216(1), 152-75 ** co-corresponding authors - Clonal evolution patterns in acute myeloid leukemia with NPM1 mutation.
Cocciardi S, Dolnik A, Kapp-Schwoerer S, Rücker FG, Lux S, Blätte TJ, Skambraks S, Krönke J, Heidel FH, Schnöder TM, Corbacioglu A, Gaidzik VI, Paschka P, Teleanu V, Göhring G, Thol F, Heuser M, Ganser A, Weber D, Sträng E, Kestler HA, Döhner H, Bullinger L, Döhner K
Nat Commun 2019, 10(1), 2031 - Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition).
Cossarizza A, Chang HD, Radbruch A, Acs A, Adam D, Adam-Klages S, Agace WW, Aghaeepour N, Akdis M, Allez M, Almeida LN, Alvisi G, Anderson G, Andrä I, Annunziato F, Anselmo A, Bacher P, Baldari CT, Bari S, Barnaba V, Barros-Martins J, Battistini L, Bauer W, Baumgart S, Baumgarth N, Baumjohann D, Baying B, Bebawy M, Becher B, Beisker W, Benes V, Beyaert R, Blanco A, Boardman DA, Bogdan C, Borger JG, Borsellino G, Boulais PE, Bradford JA, Brenner D, Brinkman RR, Brooks AES, Busch DH, Büscher M, Bushnell TP, Calzetti F, Cameron G, Cammarata I, Cao X, Cardell SL, Casola S, Cassatella MA, Cavani A, Celada A, Chatenoud L, Chattopadhyay PK, Chow S, Christakou E, Čičin-Šain L, Clerici M, Colombo FS, Cook L, Cooke A, Cooper AM, Corbett AJ, Cosma A, Cosmi L, Coulie PG, Cumano A, Cvetkovic L, Dang VD, Dang-Heine C, Davey MS, Davies D, De Biasi S, Del Zotto G, Dela Cruz GV, Delacher M, Della Bella S, Dellabona P, Deniz G, Dessing M, Di Santo JP, Diefenbach A, Dieli F, Dolf A, Dörner T, Dress RJ, Dudziak D, Dustin M, Dutertre CA, Ebner F, Eckle SBG, Edinger M, Eede P, Ehrhardt GRA, Eich M, Engel P, Engelhardt B, Erdei A, Esser C, Everts B, Evrard M, Falk CS, Fehniger TA, Felipo-Benavent M, Ferry H, Feuerer M, Filby A, Filkor K, Fillatreau S, Follo M, Förster I, Foster J, Foulds GA, Frehse B, Frenette PS, Frischbutter S, Fritzsche W, Galbraith DW, Gangaev A, Garbi N, Gaudilliere B, Gazzinelli RT, Geginat J, Gerner W, Gherardin NA, Ghoreschi K, Gibellini L, Ginhoux F, Goda K, Godfrey DI, Goettlinger C, González-Navajas JM, Goodyear CS, Gori A, Grogan JL, Grummitt D, Grützkau A, Haftmann C, Hahn J, Hammad H, Hämmerling G, Hansmann L, Hansson G, Harpur CM, Hartmann S, Hauser A, Hauser AE, Haviland DL, Hedley D, Hernández DC, Herrera G, Herrmann M, Hess C, Höfer T, Hoffmann P, Hogquist K, Holland T, Höllt T, Holmdahl R, Hombrink P, Houston JP, Hoyer BF, Huang B, Huang FP, Huber JE, Huehn J, Hundemer M, Hunter CA, Hwang WYK, Iannone A, Ingelfinger F, Ivison SM, Jäck HM, Jani PK, Jávega B, Jonjic S, Kaiser T, Kalina T, Kamradt T, Kaufmann SHE, Keller B, Ketelaars SLC, Khalilnezhad A, Khan S, Kisielow J, Klenerman P, Knopf J, Koay HF, Kobow K, Kolls JK, Kong WT, Kopf M, Korn T, Kriegsmann K, Kristyanto H, Kroneis T, Krueger A, Kühne J, Kukat C, Kunkel D, Kunze-Schumacher H, Kurosaki T, Kurts C, Kvistborg P, Kwok I, Landry J, Lantz O, Lanuti P, LaRosa F, Lehuen A, LeibundGut-Landmann S, Leipold MD, Leung LYT, Levings MK, Lino AC, Liotta F, Litwin V, Liu Y, Ljunggren HG, Lohoff M, Lombardi G, Lopez L, López-Botet M, Lovett-Racke AE, Lubberts E, Luche H, Ludewig B, Lugli E, Lunemann S, Maecker HT, Maggi L, Maguire O, Mair F, Mair KH, Mantovani A, Manz RA, Marshall AJ, Martínez-Romero A, Martrus G, Marventano I, Maslinski W, Matarese G, Mattioli AV, Maueröder C, Mazzoni A, McCluskey J, McGrath M, McGuire HM, McInnes IB, Mei HE, Melchers F, Melzer S, Mielenz D, Miller SD, Mills KHG, Minderman H, Mjösberg J, Moore J, Moran B, Moretta L, Mosmann TR, Müller S, Multhoff G, Muñoz LE, Münz C, Nakayama T, Nasi M, Neumann K, Ng LG, Niedobitek A, Nourshargh S, Núñez G, O'Connor JE, Ochel A, Oja A, Ordonez D, Orfao A, Orlowski-Oliver E, Ouyang W, Oxenius A, Palankar R, Panse I, Pattanapanyasat K, Paulsen M, Pavlinic D, Penter L, Peterson P, Peth C, Petriz J, Piancone F, Pickl WF, Piconese S, Pinti M, Pockley AG, Podolska MJ, Poon Z, Pracht K, Prinz I, Pucillo CEM, Quataert SA, Quatrini L, Quinn KM, Radbruch H, Radstake TRDJ, Rahmig S, Rahn HP, Rajwa B, Ravichandran G, Raz Y, Rebhahn JA, Recktenwald D, Reimer D, Reis E Sous
Eur J Immunol 2019, 49(10), 1457-973 - Wnt Signaling Mediates the Aging-Induced Differentiation Impairment of Intestinal Stem Cells.
Cui H, Tang D, Garside GB, Zeng T, Wang Y, Tao Z, Zhang L, Tao S
Stem Cell Rev Rep 2019, 15(3), 448-55