Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
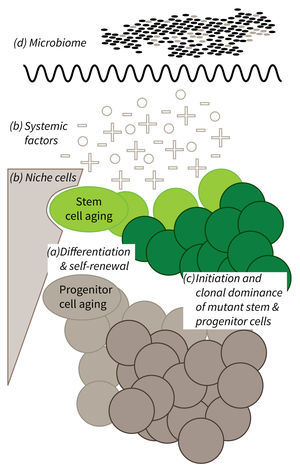
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2020
- Wnt7a Counteracts Cancer Cachexia.
Schmidt M, Poser C, von Maltzahn J
Mol Ther Oncolytics 2020, 16, 134-46 - Isolation and ex vivo cultivation of single myofibers from porcine muscle.
Stange K, Ahrens HE, von Maltzahn J, Röntgen M
In Vitro Cell Dev Biol Anim 2020, 56(8), 585-92 - The role of Igf2bp2 in hematopoietic stem cell aging
Suo M
Dissertation 2020, Jena, Germany - Dietary restriction increases protective gut bacteria to rescue lethal methotrexate-induced intestinal toxicity.
Tang D, Zeng T, Wang Y, Cui H, Wu J, Zou B, Tao Z, Zhang L, Garside GB, Tao S
Gut Microbes 2020, 1(1714401), 1-21 - Hematopoietic stem and progenitor cell-restricted Cdx2 expression induces transformation to myelodysplasia and acute leukemia.
Vu T, Straube J, Porter AH, Bywater M, Song A, Ling V, Cooper L, Pali G, Bruedigam C, Jacquelin S, Green J, Magor G, Perkins A, Chalk AM, Walkley CR, Heidel FH, Mukhopadhyay P, Cloonan N, Gröschel S, Mallm JP, Fröhling S, Scholl C, Lane SW
Nat Commun 2020, 11(1), 3021 - High Canonical Wnt/β-Catenin Activity Sensitizes Murine Hematopoietic Stem and Progenitor Cells to DNA Damage.
Wang Y, Cui H, Tao S, Zeng T, Wu J, Tao Z, Zhang L, Zou B, Chen Z, Garside GB, Tang D
Stem Cell Rev Rep 2020, 16(1), 212-21 - S1P lyase inhibition protects against sepsis by promoting disease tolerance via the S1P/S1PR3 axis.
Weigel C, Hüttner SS, Ludwig K, Krieg N, Hofmann S, Schröder NH, Robbe L, Kluge S, Nierhaus A, Winkler MS, Rubio I, von Maltzahn J, Spiegel S, Gräler MH
EBioMedicine 2020, 58, 102898 - Ontogeny of arterial macrophages defines their functions in homeostasis and inflammation.
Weinberger T, Esfandyari D, Messerer D, Percin G, Schleifer C, Thaler R, Liu L, Stremmel C, Schneider V, Vagnozzi RJ, Schwanenkamp J, Fischer M, Busch K, Klapproth K, Ishikawa-Ankerhold H, Klösges L, Titova A, Molkentin JD, Kobayashi Y, Engelhardt S, Massberg S, Waskow C, Perdiguero EG, Schulz C
Nat Commun 2020, 11(1), 4549
2019
- Analyzing Satellite Cell Function During Skeletal Muscle Regeneration by Cardiotoxin Injury and Injection of Self-delivering siRNA In Vivo.
Ahrens* HE, Henze* H, Schüler SC, Schmidt M, Hüttner SS, von Maltzahn J
J Vis Exp 2019, e60194 * equal contribution - Adaptive immunodeficiency accelerates the development of intestinal atrophy in telomere dysfunctional mice during ageing
Bajwa S
Dissertation 2019, Jena, Germany