Jena/Tel Aviv. So wie im täglichen Leben unzählige Briefe oder Pakete mit Waren verschickt werden, gibt es ähnliche Transportprozesse auch in jeder Zelle unseres Körpers. Tagtäglich müssen neu synthetisierte Proteine, die „Waren“, mit hoher Zuverlässigkeit an ihren endgültigen Bestimmungsort transportiert werden. Hinter den Kulissen erfordert dieser Transport eine umfangreiche Logistik, denn nur so können die Proteine gezielt von Station zu Station weitergeleitet werden, um sie von ihrem Syntheseort an verschiedene Stellen innerhalb der Zelle oder aus der Zelle hinaus an verschiedene Orte im Körper zu transportieren.
Ein Drittel aller neu synthetisierten Proteine wird in den Zellen über den sekretorischen Weg transportiert. Dieser Weg besteht aus dem endoplasmatischen Retikulum (ER), der "Fabrik", und dem Golgi-Apparat, dem wichtigsten "Logistikzentrum" für die weitere Verteilung der Ware in der Zelle. Doch wie kommt die Ware von der Fabrik zum Logistikzentrum, also vom ER zum Golgi-Apparat?
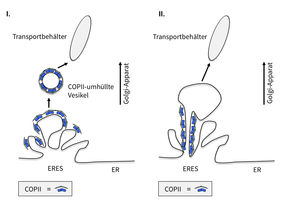
Die bis dato vorherrschende Ansicht in der Zellbiologie ist, dass sich durch Abschnürung (Abknospung) vom ER kleine Membranvesikel bilden, die mit den zu transportierenden Proteinen beladen werden. Diese Membranvesikel verbinden sich dann zu größeren Transportbehältern, die entlang sogenannter "Eisenbahnschienen", den Mikrotubuli in der Zelle, letztlich zum Golgi-Apparat transportiert werden. Dort verschmelzen diese Transportbehälter mit der Golgi-Membran und geben ihre Ware, die Proteine, zur weiteren Verteilung frei. Wichtig für diesen Prozess ist eine spezielle Hülle, die COPII-Hülle, die dabei hilft, zu Beginn des Transportes die Proteine am ER zu konzentrieren und in Membranvesikeln abzuknospen, die deshalb COPII-ummantelte Vesikel (Transportvesikel; (engl. coat protein complex II = „Mantel-Protein-Komplex II“) genannt werden. Doch dieses Wissen muss nun überarbeitet werden.
Paradigmenwechsel in der Zellbiologie
Israelische Forscher um Prof. Koret Hirschberg von der Tel Aviv University (TAU) und deutsche Forscher um Dr. Christoph Kaether vom Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut (FLI) in Jena legten jetzt in einer im Journal of Cell Biology veröffentlichten Studie ein anderes Modell für den Proteintransport in der Zelle und die Rolle von COPII nahe.
"Es gestaltete sich für uns sehr schwierig, diese neuen Ergebnisse zu veröffentlichen", berichtet Prof. Hirschberg, "weil sie unser Wissen in der Zellbiologie, die Hypothese des Vesikeltransports, deutlich widerlegen. Ohne die Zusammenarbeit mit Dr. Kaether und seinem Team am FLI, wäre die vorliegende Studie gar nicht umsetzbar gewesen".
COPII-Komplex - Erste Sortierstation für Proteine
Das Forscherteam erhielt mit Hilfe neuester mikroskopischer Methoden Einblicke in lebende Säugetierzellen und konnte durch ergänzende biochemische Analysen bestätigen, dass die COPII-Komponenten eine wichtige Rolle beim Transportprozess spielen. Doch nicht so, wie es das Schulwissen bis dato vermittelt. Im Gegensatz zur vorherrschenden Meinung, dass COPII-umhüllte Vesikel die Proteine transportieren, verlassen die COPII-Komplexe das endoplasmatische Retikulum nicht. Sie verbleiben dauerhaft an den Austrittstellen des ER und übernehmen dort die Rekrutierung, Sortierung und den Austritt der Proteine aus dem ER.
COPII-Komplexe sind stabil und unbeweglich
Die Proteine verlassen das ER also nicht in COPII-umhüllten Vesikeln, wie bisher postuliert, sondern in größeren, oft langgestreckten COPII-freien Transporteinheiten. „Anstatt Vesikel abzuknospen und zu umhüllen, wirkt COPII wie ein Pförtner direkt an der Grenze zwischen ER und ERES, den Austrittsstellen des ER, wo er die Konzentration der Ladung kontrolliert und steuert“, so Dr. Kaether.
Eine zeitgleich veröffentlichte Studie in Cell (https://doi.org/10.1016/j.cell.2021.03.035) von Jennifer Lippincott-Schwartz, einer renommierten Membrantransportexpertin vom Howard Hughes Medical Institute, USA, kam zu sehr ähnlichen Forschungsergebnissen und untermauert die Daten der FLI/TAU-Kollaboration.
"Beide Arbeiten verändern die heutige Sicht auf einen der grundlegendsten Prozesse in der Zellbiologie, den Export aus dem ER“, unterstreicht Dr. Kaether die Ergebnisse. „Da es sich hierbei für die Zelle um einen essentiellen Transportweg handelt, ist es nicht verwunderlich, dass er auch beim Alternsprozess und bei vielen Krankheiten eine wichtige Rolle spielt - von häufigen Krankheiten wie Krebs über neurologische Erkrankungen bis hin zu seltenen Erbkrankheiten", ergänzt Dr. Kaether, der mitverantwortliche Autor vom FLI.
Die hier vorgestellten Daten legen den Grundstein für ein alternatives Modell, über die Rolle des COPII-Komplexes beim Export aus dem ER. Ein genaueres Verständnis der zugrundeliegenden Mechanismen des Proteintransports wird dabei helfen, Krankheitsmechanismen besser zu verstehen und die Grundlage für neuartige Therapieansätze zu schaffen.
Publikation
COPII collar defines the boundary between ER and ER exit site and does not coat cargo containers. Shomron O, Nevo-Yassaf I, Aviad T, Yaffe Y, Zahavi EE, Dukhovny A, Perlson E, Brodsky I, Yeheskel A, Pasmanik-Chor M, Mironov A, Beznoussenko GV, Mironov AA, Sklan EH, Patterson GH, Yonemura Y, Sannai M, Kaether C, Hirschberg K. J Cell Biol. 2021 Jun 7;220(6):e201907224. doi: 10.1083/jcb.201907224.
Kontakt
Dr. Kerstin Wagner
Presse- und Öffentlichkeitsarbeit
Tel.: 03641-656378, E-Mail: presse@leibniz-fli.de