Jena. Das Genom umfasst alle in einer Zelle vorhandenen Erbinformationen und ist beim Menschen in Form von DNA auf den Chromosomen im Zellkern gespeichert. Das Genom ist fortwährend äußeren und inneren Faktoren ausgesetzt, die zu DNA-Schäden führen können, wie z.B. Umweltgiften, Strahlung und reaktiven Sauerstoffspezies. Die daraus resultierenden Schäden an der DNA-Doppelhelix stellen eine große Bedrohung für den Organismus dar. Daher sind Zellen mit sensitiven und dennoch robusten DNA-Schadensreparaturmechanismen (DNA Damage Response; DDR) ausgestattet, die nicht nur die direkte Reparatur des Schadens umfassen, sondern auch Signalwege darstellen, die das Überleben der Zelle kontrollieren und somit die Integrität des Genoms schützen.
Das ATR-Protein (Ataxia Telangiectasia and Rad3 related) ist ein Hauptregulator, der bei der DNA-Synthese als Reaktion auf Replikationsstress die DNA-Schadenssignalisierung und die DNA-Reparatur steuert und bei Bedarf den Zellzyklus stoppt. Das bedeutet, dass Zellen oder Gewebe mit einer hohen Replikationskapazität den Verlust von ATR nicht tolerieren können. Der vollständige Verlust von ATR ist daher für die Zellen und Organismen tödlich. Hypomorphe Mutationen in ATR (teilweiser Verlust der Genfunktion) verursachen dagegen beim Menschen das Seckel-Syndrom, eine Instabilitätsstörung der Chromosomen. Patienten, die an diesem Syndrom leiden, sind durch Zwergenwuchs, Entwicklungsverzögerung, Mikrozephalie und geistige Behinderung gekennzeichnet. Oft auch verbunden mit einem senilen, progeroiden Erscheinungsbild mit vorzeitiger Alterungssymptomatik, was auf eine bisher noch unbekannte Rolle von ATR hindeutet. Bis heute ist jedoch nicht bekannt, ob und wie Mutationen in ATR die neuronale Funktionalität von postmitotischen Neuronen (nicht mehr teilungsfähigen Zellen) regulieren und neurologische Symptome, wie Mikrozephalie, Lerndefizite und geistige Behinderung hervorrufen können.
Welche Auswirkungen der ATR-Verlust auf die Gehirnentwicklung und die Funktionalität von Neuronen hat, untersuchten mit Hilfe von gentechnisch veränderten Mausmodellen Forscher um Prof. Zhao-Qi Wang, Leiter der Arbeitsgruppe "Genomische Stabilität" am Leibniz-Institut für Altersforschung - Fritz-Lipmann-Institut (FLI) in Jena, in Zusammenarbeit mit Prof. Christian Geis, Sektion Neuroimmunologie am Universitätsklinikum Jena. „Fehlte ATR in den embryonalen neuronalen Vorläufer- oder anderen proliferierenden Zellen, zeigten die Tiere schwere neurologische Entwicklungsdefekte und starben schon kurz nach der Geburt,“ erläutert Dr. Murat Kirtay, der die Analysen im Rahmen seiner Doktorarbeit durchführte. Im Gegensatz dazu hatten die Mausstämme, bei denen ATR in den postmitotischen Neuronen fehlte, eine normale Lebenserwartung.
„Unsere Studie belegt, dass, wenn ATR selektiv aus sich nicht mehr teilenden Zellen entfernt wird, die Lebensfähigkeit der Neuronen nicht beeinträchtigt ist und für die Bildung und Struktur des Mausgehirns entbehrlich ist,“ informiert Dr. Kirtay, Erstautor der bei Nature Communications erschienenen Studie. Das bedeutet, bleiben die Zellen vom Replikationsstress verschont, ist eine Aufhebung der ATR-DDR-Achse durch Verlust von ATR weder für die postmitotischen Neuronen toxisch noch entscheidend für die Gehirnentwicklung.
Neue Rolle von ATR in postmitotischen Neuronen
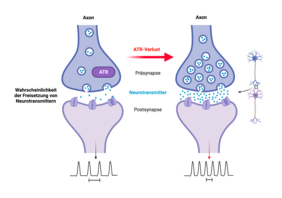
Der ATR-Verlust führt jedoch zu Defiziten der Kleinhirnfunktion, denn trotz scheinbar normaler Struktur und Morphologie des Kleinhirns zeigten Mäuse mit ATR-Mutation in den Purkinje-Zellen des Kleinhirns auffällige Bewegungsstörungen. Im Vergleich zur Kontrollgruppe wiesen sie Defizite in der motorischen Koordination auf, was besonders bei alten Mäusen auffällig war.
Darüber hinaus führte mit zunehmendem Alter der Verlust von ATR in exzitatorischen (erregten) Neuronen im Großhirn zu sporadischen, nicht-tödlichen epileptischen Anfällen. „Da Epilepsie durch Änderungen der synaptischen Übertragung und neuronalen Aktivität hervorgerufen werden kann, deutet das Auftreten epileptischer Anfälle stark darauf hin, dass bei den mutierten Mäusen altersabhängige Veränderungen der neuronalen Erregbarkeit resultieren, die Nervenzellen anfälliger für Stress oder Umweltreize machen“, deutet Prof. Zhao-Qi Wang die vorliegenden Ergebnisse. Der ATR-Verlust in den Neuronen führt zu einer Übererregbarkeit und senkt die Schwelle für epileptische Anfälle. „Obwohl ATR als essentieller DDR-Regulator bekannt ist, zeigte unsere Studie eine bisher unbekannte wichtige und physiologische Funktion von ATR auch in der Regulierung neuronaler Aktivität“, so Prof. Wang weiter.
ATR reguliert die intrinsische neuronale Aktivität
„Trotz der normalen Morphologie des Kleinhirns und des Großhirns waren die Neurone ohne ATR in ihrer synaptischen Funktion beeinträchtigt. Elektrophysiologische Analysen der Mausmodelle zeigten eine erhöhte intrinsische neuronale Erregbarkeit und Feuerrate der Neurone sowie eine gesteigerte Funktion der Präsynapsen“, erläutert Prof. Geis. Durch den ATR-Verlust werden in den Neuronen weder DNA-Schäden induziert noch die DDR-Signalwege aktiviert, d.h. die beobachteten synaptischen Defekte sind hiervon unabhängig. Die Studie gibt somit Einblicke in grundlegende Mechanismen, die den neurologischen Symptomen des Seckel-Syndroms zugrunde liegen können.
„Unsere Studie zeigt, dass der Verlust von ATR in Neuronen mit der Gehirnentwicklung und dem Leben vereinbar ist, aber zu einer hohen Anfälligkeit für epileptische Anfälle führt“, fasst Prof. Wang die Ergebnisse zusammen. Diese neurologischen Defekte manifestieren sich vor allem während des Alternsprozesses. „Darüber hinaus konnten wir erstmals aufzeigen, dass ATR eine bisher unbekannte, aber wichtige Rolle bei der neuronalen und synaptischen Funktion und Erregbarkeit besitzt, was über die bereits bekannten DDR-Signalwege weit hinausgeht. Diese überraschend neue Entdeckung ist daher wichtig für Kliniker und Wissenschaftler auf dem Gebiet der DNA-Reparatur, der Neurobiologie sowie der neuronalen Homöostase“.
Publikation
ATR regulates neuronal activity by modulating presynaptic firing. Murat Kirtay, Josefine Sell, Christian Marx, Holger Haselmann, Mihai Ceanga, Zhong-Wei Zhou, Vahid Rahmati, Joanna Kirkpatrick, Katrin Buder, Paulius Grigaravicius, Alessandro Ori, Christian Geis & Zhao-Qi Wang. Nat Commun 2021, 12, 4067. https://doi.org/10.1038/s41467-021-24217-2
Kontakt
Dr. Kerstin Wagner
Presse- und Öffentlichkeitsarbeit
Tel.: 03641-656378, E-Mail: presse@~@leibniz-fli.de