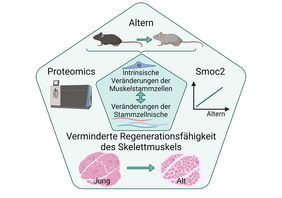
Jena. Die Skelettmuskulatur besitzt eine bemerkenswerte Regenerationsfähigkeit, die von den Muskelstammzellen (MuSCs) – auch Satellitenzellen genannt – abhängt. Tritt z.B. durch eine Verletzung eine Schädigung des Muskels ein, teilen sich die MuSCs sehr schnell und ersetzen das geschädigte Muskelgewebe. Dabei interagieren die MuSCs mit ihrer unmittelbaren zellulären Umgebung, die auch als Stammzellnische bezeichnet wird. Die Interaktion mit der Nische ist erforderlich, um die MuSCs mit den richtigen Signalen zur Selbsterneuerung, Proliferation und Differenzierung zu versorgen.
Ein wichtiger Bestandteil der MuSC-Nische ist die extrazelluläre Matrix (ECM), die während der Regeneration von verschiedenen Zelltypen umgebaut wird. Studien haben bereits gezeigt, dass die ECM-Komponenten eine kritische Rolle für die Funktionalität der Muskelstammzellen einnehmen. Der korrekte zeitliche Ablauf des Umbaus der Nische ist Voraussetzung für eine funktionelle Regeneration des Skelettmuskels und wird durch die kontrollierte Aktivierung verschiedener Zelltypen, wie z.B. Makrophagen und Fibroblasten, vermittelt.
Während des Alterns nimmt die Regenerationsfähigkeit der Skelettmuskulatur ab, dies ist teilweise durch die Verringerung der Anzahl der Muskelstammzellen, aber auch durch Beeinträchtigungen in ihrer Funktionalität bedingt. Obwohl bereits für einzelne ECM-Proteine gezeigt wurde, dass Veränderungen in ihrer Menge zur funktionellen Beeinträchtigung der MuSCs beitragen, fehlte bislang eine umfassende Charakterisierung der Auswirkungen des Alterns auf die MuSC-Nische und wie diese Veränderungen mit den intrinsischen Veränderungen in den alternden MuSCs interagieren.
Die Arbeitsgruppen von Dr. Alessandro Ori (Proteom-Experte) und Dr. Julia von Maltzahn (Muskelstammzell-Expertin) am Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut (FLI) in Jena haben nun in Kooperation mit Partnern der University of Coimbra in Portugal und des Wellcome Sanger Institute in Großbritannien mittels umfassender Proteomanalysen untersucht, wie das Altern die Kommunikation zwischen MuSCs und ihrer Nische verändert. Die Studie ist jetzt in Cell Reports erschienen.
Altern verändert das Proteom der MuSCs
"Wir haben Methoden entwickelt, die es uns erlauben, tausende Proteine sowohl im Skelettmuskel wie auch in frisch isolierten Muskelstammzellen zu untersuchen,“ berichtet Dr. Svenja Schüler, die die Studien im Rahmen ihrer Doktorarbeit in der Forschungsgruppe Ori am FLI durchführte. „Durch Vergleiche des Proteoms frisch isolierter Muskelstammzellen und der Zusammensetzung der extrazellulären Matrix des Skelettmuskels in drei verschiedenen Altersgruppen junger bis geriatrischer Mäuse konnten wir hunderte Proteine identifizieren, die entweder in Muskelstammzellen oder in ihrer direkten Umgebung Veränderungen aufweisen.“
„Der Vergleich des MuSCs-Proteoms der verschiedenen Altersgruppen wies auf eine deutliche Alternssignatur hin; ein Indiz dafür, dass die Funktionalität der MuSCs bereits in alten Mäusen beeinträchtigt ist und sich in geriatrischen Mäusen weiter verschlechtert“, erläutert Dr. Alessandro Ori, Forschungsgruppenleiter am FLI. „Im nächsten Schritt haben wir uns auf die Proteine konzentriert, die sowohl in alten als auch in geriatrischen MuSCs signifikant verändert waren. Dadurch fanden wir Hinweise, dass diese Proteine eine wichtige Rolle in Stoffwechselprozessen und bei der Protein-Homöostase haben. Ferner beeinflussen sie die Kommunikation mit der Stammzellnische.“
Altern verändert die extrazelluläre Matrix im Skelettmuskel / der MuSC-Nische
Durch die Analyse des Proteoms des Skelettmuskels wurden fast zweihundert extrazelluläre oder sekretierte Proteine nachgewiesen, die im Zuge der Alterung betroffen sind. Besonders hervorzuheben ist, dass bereits in alten Tieren die ECM verändert ist. Dies deutet darauf hin, dass die beobachteten Veränderungen bereits früh im Alternsprozess auftreten. Zur Untersuchung, welche Zelltypen am meisten zu den Veränderungen in der Muskelstammzellnische beitragen, wurden Single-Cell-RNA-Sequenzdaten mit den gewonnenen Proteom-Daten verglichen. „Wir konnten so die Mehrheit der Proteine der extrazellulären Matrix, die Veränderungen aufwiesen, mindestens einem bestimmten Zelltyp eindeutig zuordnen.“ berichtet Dr. Julia von Maltzahn, Forschungsgruppenleiterin am FLI. „Zusammenfassend haben wir eine Alterssignatur der extrazellulären Matrix identifiziert, die in verschiedenen Skelettmuskeln konserviert ist. Dies unterstützt unsere These, dass die Muskelstammzellnische in verschiedenen Muskeln des Körpers mit steigendem Alter progressiv verändert wird.“
Die Regeneration des Skelettmuskels geht mit einem dynamischen Umbau der MuSC-Nische einher, so dass jeder Schritt des Regenerationsprozesses spezifisch kontrolliert wird. Zur weiteren Analyse fokussierten sich die Wissenschaftler auf das sekretierte Protein Smoc2. Smoc2 wurde ausgewählt, da es eines der Proteine war, welches die größten Veränderungen während des Alterns und der Muskelregeneration zeigte. Um herauszufinden, wann und wie Smoc2 den Regenerationsprozess beeinflusst, wurde die Dynamik der Smoc2-Expression während der Regeneration junger Skelettmuskeln untersucht. „Wir haben Smoc2 als einen Modulator der Signalübertragung zwischen MuSCs und ihrer Nische identifiziert. Außerdem konnten wir zeigen, dass dieses Protein zur gestörten Signalübertragung in MuSCs während des Alterns beiträgt“, erklärt Dr. Schüler. Ungewöhnlich hohe Konzentrationen von Smoc2, wie sie mit dem Altern beobachtet wurden, reichten aus, um auch die Funktionalität der MuSCs in jungen Mäusen in Folge wiederholter Muskelverletzungen zu beeinträchtigen.
„Unsere Studie belegt die Komplexität der Veränderungen in der Signalübertragung im gealterten Skelettmuskel, die zum einen durch Veränderungen in der Menge verschiedener Komponenten der Muskelstammzellnische, zum anderen in Oberflächenrezeptoren der Muskelstammzellen bedingt sind. Zukünftige Forschungsarbeiten zur Entwicklung therapeutischer Ansätze sollten diese Komplexität berücksichtigen“, erläutert Dr. von Maltzahn.
Die hier vorgestellten Arbeitsabläufe zur Analyse des Proteoms ermöglichen zukünftig die kombinierte Analyse des Proteoms und Transkriptoms der MuSCs. Dies wird ein tieferes Verständnis der funktionellen Veränderungen während der Alterung ermöglichen. Durch das Aufzeigen der Hauptsignalwege, die im Zuge des Alterns betroffen sind und durch Identifikation der Zelltypen, die am meisten zu diesen Veränderungen beitragen, erlaubt diese Arbeit eine neue Sichtweise auf die komplexen Prozesse, die zur verminderten Regeneration des Skelettmuskels im Alter führen. Des Weiteren liefert sie auch neue Ansatzpunkte zur Entwicklung geeigneter Therapien.
Publikation
Extensive remodeling of the extracellular matrix during aging contributes to age dependent impairments of muscle stem cell functionality. Svenja C. Schüler, Joanna M. Kirkpatrick, Manuel Schmidt, Deolinda Santinha, Philipp Koch, Simone Di Sanzo, Emilio Cirri, Martin Hemberg, Alessandro Ori, Julia von Maltzahn. Cell Reports 2021, 35, 109223. doi: 10.1016/j.celrep.2021.109223. https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00574-X
Kontakt
Dr. Kerstin Wagner
Presse- und Öffentlichkeitsarbeit
Tel.: 03641-656378, E-Mail: presse@~@leibniz-fli.de