Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
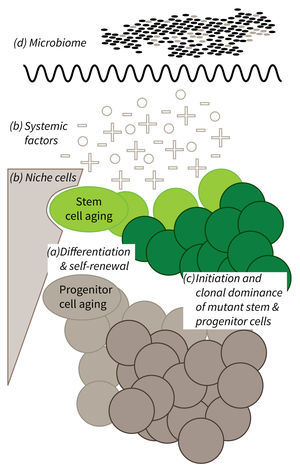
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2017
- Identification of novel Hox target genes with essential roles in hematopoietic stem cell self-renewal and differentiation
Baig AH
Dissertation 2017, Jena, Germany - RSK-mediated nuclear accumulation of the cold-shock Y-box protein-1 controls proliferation of T cells and T-ALL blasts.
Gieseler-Halbach S, Meltendorf S, Pierau M, Weinert S, Heidel FH, Fischer T, Handschuh J, Braun-Dullaeus RC, Schrappe M, Lindquist JA, Mertens PR, Thomas U, Brunner-Weinzierl MC
Cell Death Differ 2017, 24(2), 371-83 - Planarian finds time(less) to fight infection.
Gutiérrez-Gutiérrez Ó, Felix DA, González-Estévez C
Virulence 2017, 8(7), 1043-8 - mTORC1 Activation during Repeated Regeneration Impairs Somatic Stem Cell Maintenance.
Haller S, Kapuria S, Riley RR, O'Leary MN, Schreiber KH, Andersen JK, Melov S, Que J, Rando TA, Rock J, Kennedy BK, Rodgers JT, Jasper H
Cell Stem Cell 2017, 21(6), 806-818.e5 - Gene dosage reductions of Trf1 and/or Tin2 induce telomere DNA damage and lymphoma formation in aging mice.
Hartmann K, Illing A, Leithäuser F, Baisantry A, Quintanilla-Martinez L, Rudolph KL
Leukemia 2017, 31(12), 2853 Erratum for Leukemia 2016 volume 30 page 749 - Protein phosphatase 4 regulatory subunit 2 (PPP4R2) is recurrently deleted in acute myeloid leukemia and required for efficient DNA double strand break repair.
Herzig JK, Bullinger L, Tasdogan A, Zimmermann P, Schlegel M, Teleanu V, Weber D, Rücker FG, Paschka P, Dolnik A, Schneider E, Kuchenbauer F, Heidel FH, Buske C, Döhner H, Döhner K, Gaidzik VI
Oncotarget 2017, 8(56), 95038-53 - Hacking the stem cell niche.
Lane SW, Heidel FH
Blood 2017, 129(22), 2951-2 - Telomerase abrogates aneuploidy-induced telomere replication stress, senescence and cell depletion.
Meena JK, Cerutti A, Beichler C, Morita Y, Bruhn C, Kumar M, Kraus JM, Speicher MR, Wang ZQ, Kestler HA, Fagagna Fdd, Günes C, Rudolph KL
EMBO J 2017, 36(19), 2922-4 Erratum for EMBO J 2015 volume 34 page 1371 - Rejuvenating Strategies for Stem Cell-Based Therapies in Aging.
Neves J, Sousa-Victor P, Jasper H
Cell Stem Cell 2017, 20(2), 161-75 - Gain of function in Jak2(V617F)-positive T-cells.
Nishanth G, Wolleschak D, Fahldieck C, Fischer T, Mullally A, Perner F, Schnöder TM, Just S, Heidel* FH, Schlüter* D
Leukemia 2017, 31(4), 1000-3 * equal contribution